PPB|沈阳农大林国林教授团队综合多组学分析探秘碱胁迫下蓖麻ROS调节机制
英文题目:Integrated physiological, transcriptomic and metabolomic analyses reveal ROS regulatory mechanisms in two castor bean varieties under alkaline stress
中文题目:综合生理学、转录组学和代谢组学分析揭示了碱胁迫下两个蓖麻品种的ROS调节机制
发表期刊:Plant Physiology and Biochemistry
影响因子:6.1
作者单位:沈阳农业大学
百趣提供服务:新一代代谢组学NGM2、转录组学
研究背景
盐碱胁迫是农业和环境领域的主要挑战之一,其对植物生长的抑制作用和环境恶化已成为全球关注的问题。在全球气候变化和土地退化的背景下,蓖麻的种植潜力和价值越来越受到关注,迄今为止,已有大量研究调查了抗逆性蓖麻对各种胁迫的反应,包括盐碱条件、重金属、温度和干旱等。然而,碱胁迫下蓖麻的ROS(活性氧)信号响应机制尚未见报道。在这种背景下,本研究采用碱敏感的淄蓖8号(ZB8)和耐碱的稼祥22号(JX22)品种来阐明耐碱蓖麻品种的氧化胁迫反应机制。
技术路线
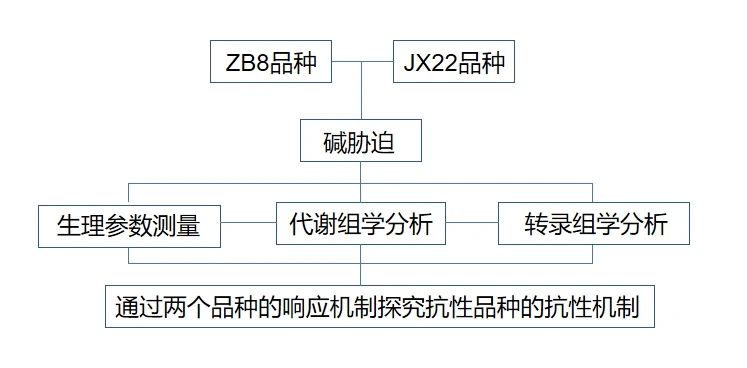
研究结果
1.碱胁迫下不同蓖麻品种的生理特性
在碱胁迫下,蓖麻品种JX22(SA22)和ZB8(SA8)形态差异明显。ZB8萎蔫更严重,根长显著缩短,根H₂O₂、MDA含量增加幅度更大,O₂⁻含量显著上升。而JX22根长不受影响,O₂⁻含量无显著变化,且抗氧化酶活性更高,能更有效清除ROS(图1)。这些结果表明,JX22表现出更优越的抗氧化能力,这在减轻ROS诱导的氧化损伤以及增强其对碱性胁迫的耐受性方面发挥了关键作用。
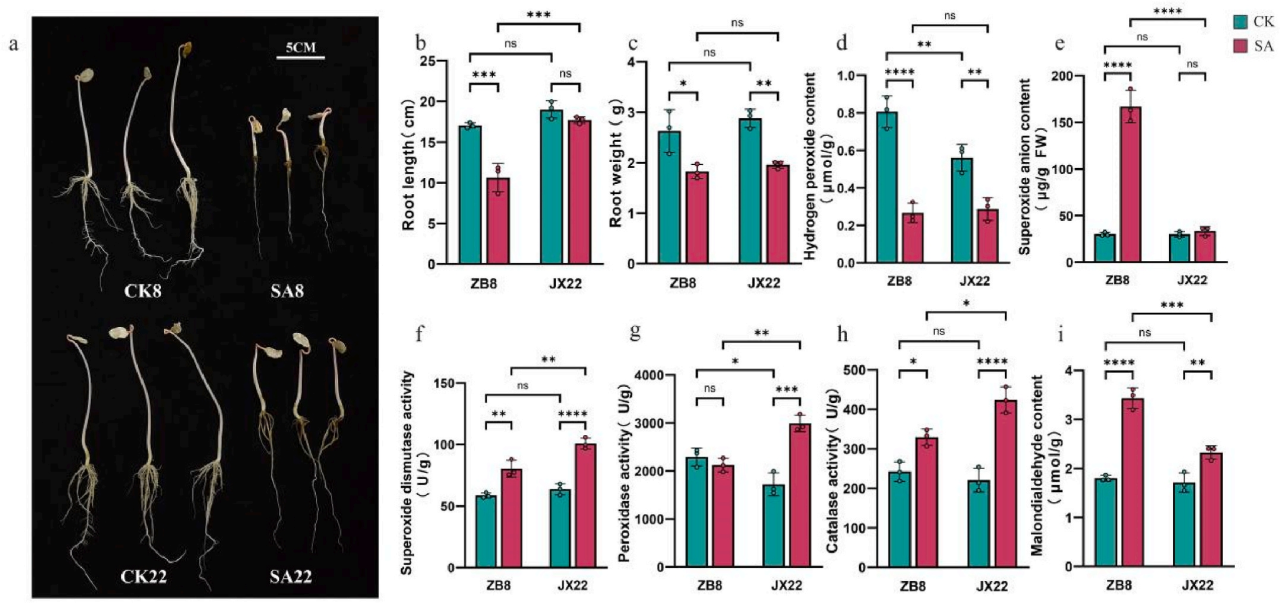
图1.ZB8和JX22蓖麻品种的生长表型和生理参数
2.转录组和代谢组数据挖掘
主成分分析(PCA)显示数据有清晰聚类模式,表明转录组数据适用于下游分析。鉴定出12264个差异表达基因(DEGs)。KEGG富集分析发现所有对照组的DEGs参与140条途径,其中CK8与CK22比较中,多种次生代谢途径(类黄酮生物合成和类胡萝卜素生物合成等)显著富集,这些途径差异可能是蓖麻品种碱胁迫耐受性不同的关键因素(图2)。类似地,对四种处理之间的代谢组学数据进行分析,KEGG途径富集分析表明,在碱性胁迫下,代谢途径、氨基酸生物合成和辅因子生物合成在两个对照组中都显著富集(图3)。

图2.不同处理下两个蓖麻品种的基因表达谱数据挖掘

图3.不同处理下两个蓖麻品种代谢产物的数据挖掘
3.碱胁迫下不同蓖麻品种根系ROS信号的产生
基于转录组数据分析,在JX22和ZB8根中鉴定了100个与ROS产生相关的差异表达基因,与CK处理相比,几乎所有的编码基因在两个品种中的线粒体、内质网以及胞质溶胶中都表现出下调,表明两个品种的线粒体和内质网中ROS的产生受到显著抑制(图4)。酰基辅酶a氧化酶(ACX)作为产生H₂O₂的关键酶,ACX编码基因在碱性胁迫下抗性和敏感品种之间表现出不同的表达模式。此外,大多数编码其他质外体ROS生成氧化酶的基因,如pH依赖的细胞壁过氧化物酶(POX)和脂肪氧化酶(LOX),在两个品种的碱性胁迫下都下调。
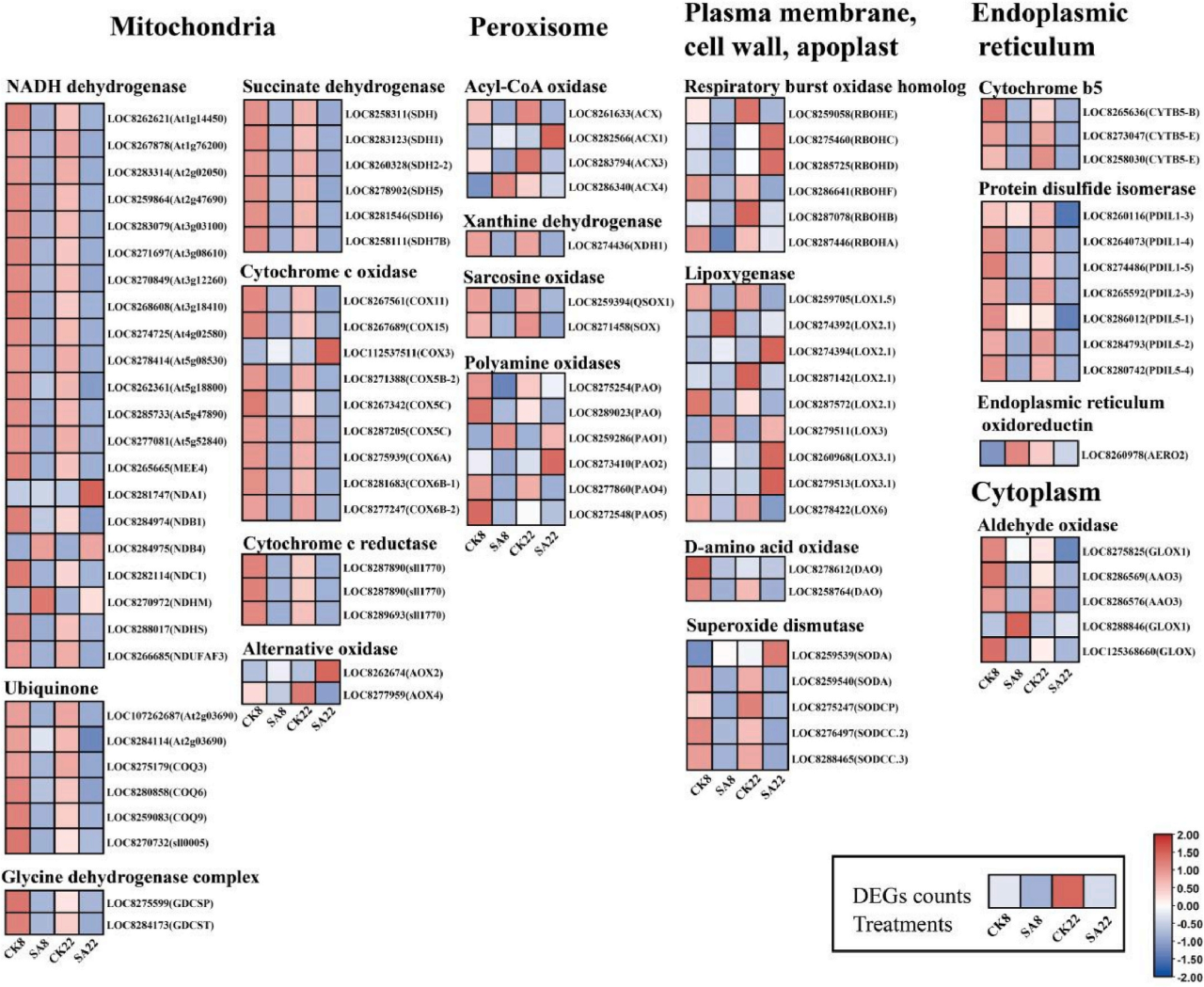
图4.不同蓖麻品种活性氧合成相关基因的热图
4.活性氧信号转导
进一步研究了参与两种蓖麻品种之间ROS信号转导的基因(图5),富含亮氨酸重复受体样激酶(LRR-RLKs)能介导非生物应激,在本研究中,碱胁迫下所有LRR-RLK编码基因均呈下调趋势。同时,两个蓖麻品种的质膜定位水通道蛋白(PIPs)和Ca²⁺通道蛋白(MSLs和TPCs)在碱胁迫处理后也一致下调。植物细胞胞质溶胶中有多种氧化还原传感网络,如谷胱甘肽过氧化物酶(GPXs)、硫氧还蛋白(TRXs)和谷氧还蛋白(GRXs),可整合ROS信号。研究发现,碱胁迫下两个品种多数此类传感器编码基因显著下调,但JX22中LOC8288062(GRXC9)表达上调10倍,显示其ROS感应能力增强,应激反应更快。胞质溶胶还包含众多信号转导中枢,能整合ROS信号与其他信号分子以调节细胞信号网络。研究显示,碱胁迫下ZB8 中这些信号转导中心编码基因显著下调,而抗性品种JX22受影响较小。这表明JX22能更有效地利用这些激酶整合ROS信号与其他信号分子,进而更好地适应碱胁迫带来的损伤。
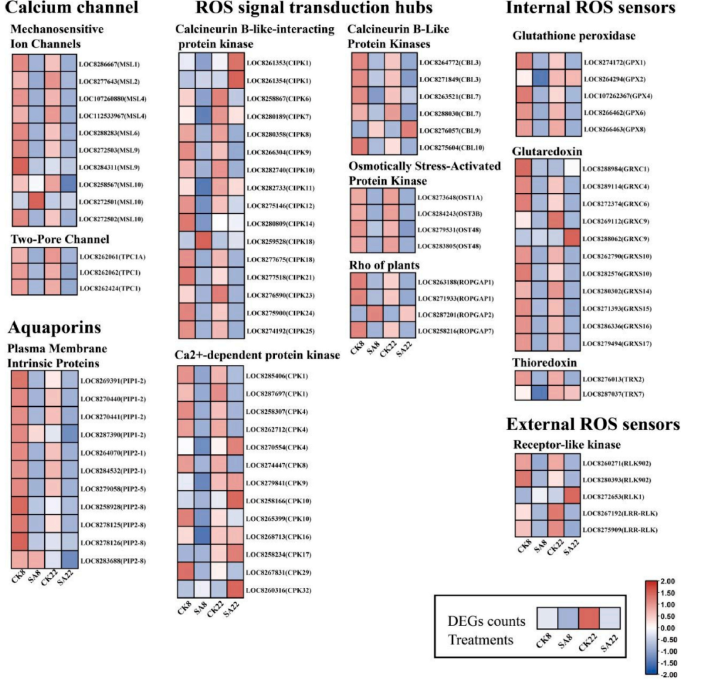
图5.不同蓖麻品种ROS信号转导相关基因的热图
5.碱胁迫下不同蓖麻品种抗坏血酸-谷胱甘肽(AsA-GSH)循环的响应
为了阐明碱性胁迫下两个蓖麻品种的酶促ROS清除机制,作者构建了参与AsA-GSH循环的差异表达基因(DEGs)的途径热图(图6)。途径热图显示,与CK处理相比,碱胁迫下两个品种的AsA-GSH循环中大多数关键酶编码基因显著下调。然而,LOC8268764 (CAT2)和LOC8259539(SODA)显示显著上调。这些基因表达模式与抗氧化酶活性结果一致(图1f-h)。有趣的是,CAT基因家族中LOC107261240(CAT2)和LOC8268764(CAT2)表达模式相反。通过氨基酸序列比对和结构域分析发现,LOC8268764(CAT2)有独特的过氧化氢酶活性位点,分解H₂O₂的能力更强。碱胁迫虽抑制两个蓖麻品种AsA-GSH循环中的多数过程,但会特别上调LOC8268764(CAT2)和LOC8259539的表达,增强抗氧化酶活性。LOC8268764(CAT2)的独特活性位点,可能是JX22耐碱能力强的关键原因。
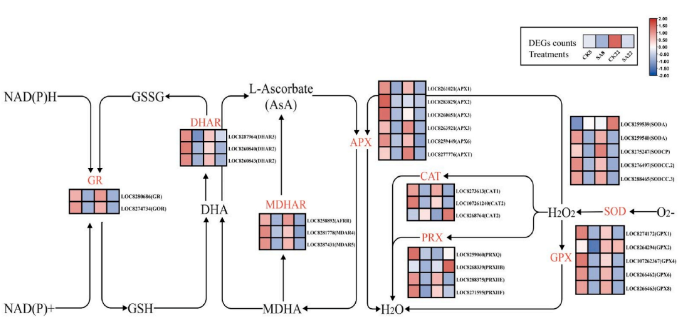
图6.抗坏血酸-谷胱甘肽循环途径的热图
6.碱胁迫下不同蓖麻品种类胡萝卜素生物合成的响应
基于转录组学和代谢组学分析,作者构建了碱胁迫下两个蓖麻品种类胡萝卜素生物合成的途径热图(图7),以进一步研究它们清除ROS的机制。转录分析显示,多数基因在同品种对照与胁迫处理间的表达模式一致,碱胁迫下显著下调。不过,类胡萝卜素合成关键基因CYP97B2在ZB8中上调、JX22中下调;降解关键基因CCD7在ZB8中下调、JX22中上调。在类胡萝卜素生物合成途径中,鉴定了四种差异表达的代谢产物:PP-植基、叶黄素、玉米黄质和脱落酸(ABA)。PP-植基作为类胡萝卜素生物合成途径中的上游底物,在碱胁迫下在两个品种中都表现出上调。叶黄素和玉米黄质表现出相同的积累模式,在ZB8中上调,在JX22中下调。ABA在两个品种碱胁迫下含量都有所下降。

图7.类胡萝卜素生物合成途径中DEGs和DAMs的综合热图
7.qRT-PCR验证
为了验证RNA-Seq数据的准确性,作者对所有四种处理中随机选择的八个DEGs进行了qRT-PCR分析。qRT-PCR结果显示,在碱胁迫下,CAT2 (LOC8268764)和ACX1在两个品种中均上调,而PIP-1-2、LRR-RLK和MSL4则下调。CPK10、CPK4和CAT2(LOC107261240)在两个品种之间表现出不同的表达模式。所有八个DEGs的表达趋势与RNA-Seq数据一致,证实了RNA-Seq结果的可靠性(图8)。
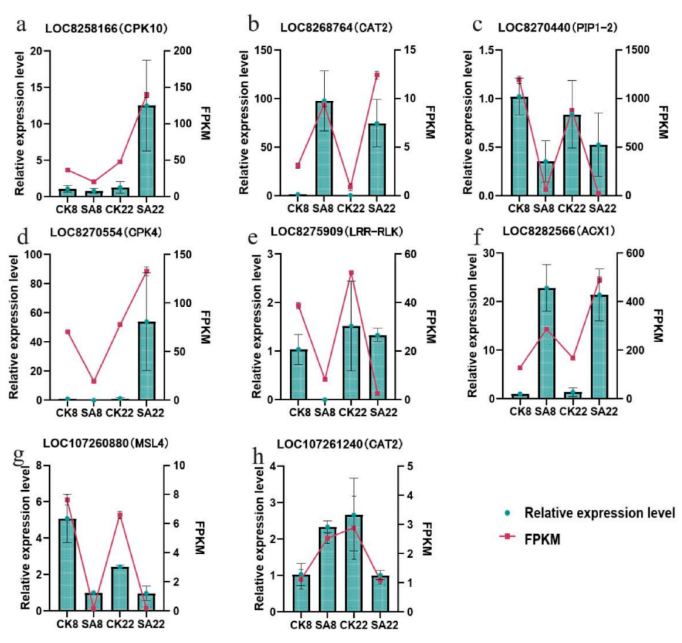
图8.八个关键基因的RNA-Seq数据的FPKM值的RT-qPCR验证
研究结论
本研究综合生理、转录和代谢分析,对比碱胁迫下蓖麻品种ZB8(敏感)和JX22(抗性)的活性氧响应机制。生理层面,JX22凭借更主动的抗氧化系统,激活抗氧化酶降低ROS水平,减轻氧化损伤,展现出更强的耐碱性。转录组学和代谢组学分析表明,JX22在碱胁迫下ROS产生能力优异,为信号转导提供底物,多种蛋白激酶显著上调协调ROS通讯。此外,JX22具有更有效的酶活性氧清除系统,而ZB8只能通过不太有效的非酶系统如类胡萝卜素抗氧化剂来减轻氧化损伤。该研究揭示了蓖麻耐碱机制,为理解碱胁迫下ROS稳态提供框架,有助于开发耐碱新品种。
END
孙贞贞 撰文
Peng 校稿
